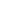 導航
導航

原創 探索菌 生物探索
在某種程度上,人類的發展史是通過知識創新和技術進步不斷與疾病做斗爭的歷史。 以癌癥為例,隨著認識的深入,這一疾病領域逐漸擺脫無藥可治的情境,以CAR-T、PD-1/PD-L1為代表的免疫療法的出現甚至一度讓人們看到攻克癌癥的曙光。 當然,這些療法僅在部分患者身上生效的事實也促使科研人員積極尋找新的腫瘤免疫療法。
當地時間10月21日,美國 紀念斯隆?凱特琳紀念癌癥中心 的免疫學家李銘所在的研究團隊在《Nature》雜志發表了兩篇“背靠背”文章“ TGF-β suppresses type 2 immunity to cancer”以及“Cancer immunotherapy via targeted TGF-β signalling blockade in TH cells ”。 這兩篇文章中, 一篇為基礎性研究,另一篇是轉化性研究 ,為人類戰勝癌癥帶來了新的希望。
文中指出,與激活免疫系統從而殺死癌細胞的這種“正面迎敵”方法相比,通過 激活免疫細胞啟動癌細胞周圍組織傷口修復的這種迂回方法同樣能夠有效治療癌癥,期間滋養癌細胞的血管將被修剪掉,癌細胞由此缺氧并死亡 。 研究人員將這種方法稱為“ 癌癥環境免疫療法 ”,并設計了一種 基于抗體的藥物4T-Trap ,已在小鼠體內成功遏制了癌癥進展。

CD4 + T細胞是抑制腫瘤發展的關鍵
轉化生長因子β(TGF-β) 是免疫穩態和免疫耐受的重要促進因子,既能抑制癌前細胞導致的腫瘤進展,也可促使腫瘤的擴散。 此前,紀念斯隆?凱特琳紀念癌癥中心的研究人員已經證明, 阻斷免疫細胞T細胞上的TGF-β表達,就能夠抑制腫瘤的發生 。
問題在于,TGF-β對多種T細胞系具有多效性作用,如果把這些通路都堵死,將會導致嚴重的后果。 因此,找到TGF-β在體內的功能靶點和癌癥調控的潛在機制至關重要。
最初,研究人員認為,CD8+T細胞,即細胞毒性T淋巴細胞(CTL)可能是抑制腫瘤發展的切入點。 然而,在乳腺癌小鼠模型中敲除了CD8+T細胞的TGF-β受體后,腫瘤生長卻并未受到抑制。 于是,研究人員轉而將目光放在輔助性的CD4+T細胞上,發現從基因上去除CD4+T細胞中的TGF-β受體可顯著抑制小鼠腫瘤的發展。
在進一步實驗中,研究人員發現, TGF-β缺失的CD4+T細胞是通過促進腫瘤組織的傷口愈合反應,從而直接對抗癌癥的發展 。
阻斷CD4+T細胞中TGF-β信號轉導重建了腫瘤血管系統,腫瘤周圍形成了一層“保護墻”,癌細胞無法從血管組織獲取營養,最終由于缺氧而死亡。 在這個過程中,輔助性T細胞分泌的 IL-4細胞因子起著積極的作用。
阻斷CD4+T細胞TGF-β信號可誘導腫瘤組織愈合、血管重組和缺氧相關癌細胞死亡
實際上,早在20世紀80年代中期,癌癥學家 Harold Dvorak 發表在《 NEJM 》的一篇文章就提出, 腫瘤本質上是“無法治愈的傷口” 。 最新的研究進一步印證了這一觀點。 腫瘤通過組織損傷早期引發的炎癥反應和血管新生來促進其生長,但是當血管完整擴張到損傷組織時,腫瘤卻永遠不會進入到傷口愈合的后期。
靶向藥物4T-Trap在小鼠實驗中表現優異
如果說第一篇文章揭示了在CD4+ T細胞中阻斷TGF-β信號從而治療癌癥的潛力,那么在第二篇文章中,研究人員則為這一理論提供了 直接證據 。
借助蛋白質工程技術,研究人員制備了具有CD4和TGF-β特異性的雙特異性抗體,同時添加了抗人CD4抗體ibalizumab,從而實現CD4 +T細胞的靶向性。 這種藥物被命名為 CD4TGF-βTrap(4T-Trap) 。
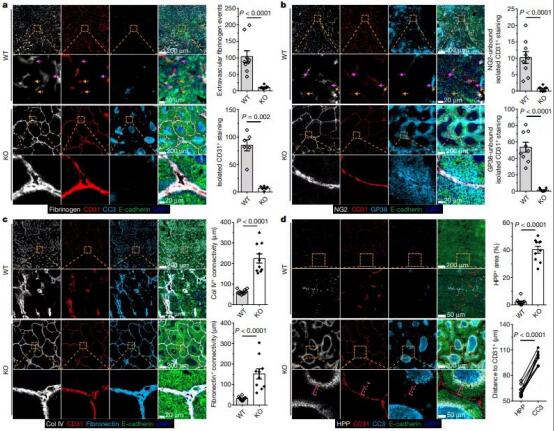
為了探究4T Trap的體內治療效果,研究人員培育了表達人類CD4的轉基因小鼠,并且CD4的表達水平與在人CD4+ T細胞上的表達水平相當。
在100μg/劑量、每周兩劑的治療方案下,4T-Trap對腫瘤生長有明顯的抑制作用 。 10劑藥之后,小鼠體內血管系統在6周內基本重組,遠離血管系統的缺氧區域發生了災難性的癌細胞死亡,并且4T-Trap治療可抑制血管滲漏。 更為重要的是, 4T-Trap能夠特異性地進入腫瘤導流淋巴結,從而有效地抑制TGF-β信號 ,這是普通TGF-β抑制劑所無法實現的。
結語
總體而言,研究人員認為,對輔助性T細胞中TGF-β信號的藥理抑制可能是一種新型癌癥療法,是對現有癌癥免疫療法的有力補充。 目前,李銘教授正在聯合紀念斯隆?凱特琳紀念癌癥中心的醫生們,共同將這項研究推向臨床。




 全國客戶服務電話
0411-62910999
全國客戶服務電話
0411-62910999



